RPLC(反相液相色谱)分离多肽技术概述
Published: 2020-11-04
Keyword: 多肽
反相液相色谱法(RPLC)是迄今为止在质谱分析之前分离肽的shǒu 选方法。
这种偏爱主要是因为该方法具有良好的分离度,可再现的结果,并且很重要的是与电喷雾电离兼容。
实际上,在现代质谱仪中,RPLC系统都可以轻松连接到电离源,这样,当肽从色谱柱上洗脱下来时,它们可以自动转移到质谱分析中。
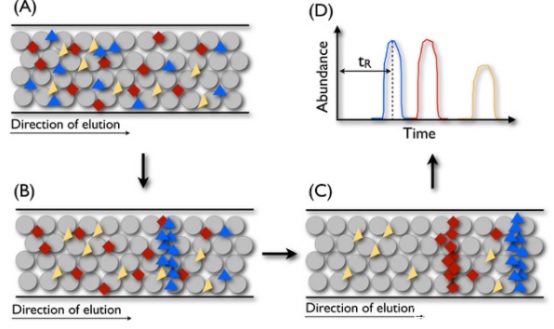
在RPLC中,根据肽的疏水性在称为色谱柱的细管中分离肽。管柱用多孔二氧化硅珠均匀地填充,使得颗粒之间的未占用空间尽可能小。
每个珠子包含附着的疏水链。对于肽分离,通常使用长烷基链,例如C8或C18,尽管也有其他选择。柱的填充通常表示为固定相。
RPLC中使用了两种类型的称为流动相的溶剂。按照惯例,这些溶剂表示为A和B。
溶剂A是指一种水性缓冲液,通常由水和0.1%的酸组成。溶剂B通常由很大dà 例的有机溶剂(如乙腈和0.1%的酸)组成。
其RPLC设备都包括一种以jīng确比例泵送和混合两种溶剂的机制。
在分离过程中,将目标肽混合物溶解在溶剂A中,并注入到色谱柱中。当它们穿过硅胶珠时,具有不同特性的肽会以不同的强度与烷基链结合。
为了将它们从色谱柱中释放出来,逐渐将越来越多的溶剂B与缓冲液A混合,然后泵送通过色谱柱(如下图)。每种肽均以特定浓度的溶剂B释放,因此代表肽种类的suǒ有单个分子大约在同一时间洗脱。
因此,如果测量色谱柱出口处的信号,则将观察到每种不同肽种类的峰。
肽需要经过色谱柱的时间很短,称为保留时间。
人们经常使用术语保留时间来指代与每种肽的洗脱峰的顶点相对应的时间(图D)。
这个时间点将与肽降低珠子和溶剂之间的表面电势的能力成比例,我们通常将这种特性称为肽的疏水性。通常,肽越疏水,保留时间越长。
由于溶剂B的比例决定了肽的洗脱,因此用于添加溶剂B的方案是其RPLC实验的重要方面。当前,常用的方法是基于线性梯度,其中溶剂B的增加遵循线性函数。
大多数肽在溶剂B的百分比达到40%之前就已洗脱出来,因此梯度通常从2%升至40%B。在运行结束时B百分比的高增加可确保将所有剩余化合物从溶剂中冲走。
RPLC的一大优势是其良好的多功能性。通过改变各种参数,例如色谱柱尺寸,固定相和流动相的组成,温度或梯度斜率,该方法可适用于分离各种化合物。
图:液相色谱原理。将与流动相混合的肽注入色谱柱(图A)。随着越来越多的溶剂B混入,肽段按疏水性顺序从色谱柱中释放出来(图B和C)。列末的信号可以在每个时间点进行测量,并显示为色谱图(图D)



 关注我们
关注我们

